Ao falar em átomo, devemos primeiramente lembrar que ninguém nunca viu um! O átomo é uma entidade muito, muito, muito pequena. Com o passar dos anos, o conhecimento científico vai se acumulando e novas tecnologias vão sendo desenvolvidas, possibilitando ter uma noção cada vez mais clara de como é e como funciona o átomo.
É por haver essa “evolução” do conhecimento da estrutura atômica, que temos diversos modelos atômicos. Vários cientistas já propuseram modelos. Segundo o dicionário Oxford de Filosofia, o termo “modelo” pode ser definido da seguinte maneira:
Representação de um sistema por outro, usualmente mais familiar, cujo funcionamento se supõe ser análogo ao do primeiro.
Ou seja, cada modelo atômico é uma representação, uma simulação do que acredita-se ser o átomo.
Vamos, agora, entender os principais modelos atômicos já propostos.
Modelo atômico de Dalton
Para Dalton, o átomo era uma partícula maciça, esférica e indivisível. Para comparação, ele descrevia o átomo como uma bola de bilhar, só que bem menor, de dimensão microscópica.
Vale lembrar que o nome “átomo” significa não divisível (a=não; tomo=parte) e foi utilizado pela primeira vez na Grécia Antiga por dois filósofos, Leucipo e Demócrito.
Modelo atômico de Thomson
No final do século XIX, Thomson realizou um experimento no qual percebeu que todas as partículas estavam carregadas de cargas elétricas negativas. Dessa forma, ele havia descoberto os elétrons. Essa descoberta fez com que Thomson percebesse que o átomo era divisível. Como o átomo é eletricamente neutro, não tinha como ele ser constituído apenas por elétrons. Assim, Thomson propôs um modelo atômico no qual o átomo fosse uma esfera maciça e positiva, com elétrons de carga negativa distribuídos na esfera. Pela descrição, esse modelo foi apelidado de “pudim de passas”.
Modelo atômico de Rutherford
O físico neozelandês Ernest Rutherford (1871-1937) trabalhava com o polônio, um elemento radioativo. Em experimentos com partículas alfa, Rutherford percebeu que os átomos deveriam estar concentrados em núcleos. Com isso, Rutherford propôs o seguinte modelo: “o átomo é formado por um núcleo pequeno, com carga positiva, no qual se concentra quase toda a massa atômica. Ao redor do núcleo estão os elétrons, de carga negativa.”
Para explicar porque os elétrons não eram atraídos para o núcleo, já que são eletricamente opostos, Rutherford propôs uma comparação com o sistema solar, no qual os elétrons estariam girando em torno do núcleo em órbitas circulares e em alta velocidade, sendo mantidos pela aceleração centrípeta. Porém, como uma carga elétrica irradia energia, o elétron em movimento perderia velocidade e “cairia” no núcleo.
Modelo atômico de Bohr
As problemáticas surgidas com o modelo atômico de Rutherford foram superadas com o modelo de Bohr, após Chadwick “descobrir” o nêutron utilizando o Princípio de Conservação da Quantidade de Movimento. No modelo de Bohr, o núcleo do átomo é formado pelos prótons de carga positiva e nêutrons de carga neutra. Ao redor do núcleo, os elétrons de carga negativa giram, distribuídos em camadas de energia.
Modelo quântico
Atualmente, um novo modelo atômico é considerado válido: o modelo quântico. Utilizando princípios da Física Quântica, alguns cientistas como Heisenberg, Schrödinger e Dirac, propuseram um modelo no qual não se tem certeza da localização do elétron, ou seja, este não tem um lugar fixo ao redor do átomo, sendo formada uma nuvem eletrônica que representa a probabilidade de se encontrar um elétron num determinado local do espaço. Para estudar esse modelo atômico, é necessário um alto conhecimento de cálculo e física quântica. Por isso, para o Ensino Médio, é suficiente saber o conceito geral do modelo quântico, sendo que o principal modelo estudado é o de Bohr.
 .
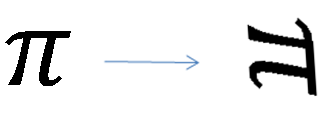
.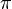 pertence aos números irracionais. Para a maioria dos cálculos simples é comum aproximar
pertence aos números irracionais. Para a maioria dos cálculos simples é comum aproximar  por 3,14. Uma boa parte das calculadoras científicas de 8 dígitos aproxima
por 3,14. Uma boa parte das calculadoras científicas de 8 dígitos aproxima 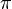 por 3,1415926. Para cálculos mais precisos pode-se utilizar com 52 casas decimais. Para cálculos ainda mais precisos pode-se obter aproximações de
por 3,1415926. Para cálculos mais precisos pode-se utilizar com 52 casas decimais. Para cálculos ainda mais precisos pode-se obter aproximações de 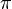 através de algoritmos computacionais.
através de algoritmos computacionais.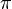 pertence aos números irracionais. Para a maioria dos cálculos simples é comum aproximar
pertence aos números irracionais. Para a maioria dos cálculos simples é comum aproximar  por 3,14. Uma boa parte das calculadoras científicas de 8 dígitos aproxima
por 3,14. Uma boa parte das calculadoras científicas de 8 dígitos aproxima 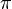 por 3,1415926. Para cálculos mais precisos pode-se utilizar com 52 casas decimais. Para cálculos ainda mais precisos pode-se obter aproximações de
por 3,1415926. Para cálculos mais precisos pode-se utilizar com 52 casas decimais. Para cálculos ainda mais precisos pode-se obter aproximações de 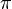 através de algoritmos computacionais.
através de algoritmos computacionais. = 3,14159 26535 89793 23846 26433 83279 50288 41971 69399 37510 58209 74944 5923078164 06286 20899 86280 34825 34211 70679 82148 08651 32823 06647 09384 46095 50582 23172 53594 08128 48111 74502 84102 70193 85211 05559 64462 29489 54930 38196 44288 10975 66593 34461 28475 64823 37867 83165 27120 19091 45648 56692 34603 48610 45432 66482 13393 60726 02491 41273
= 3,14159 26535 89793 23846 26433 83279 50288 41971 69399 37510 58209 74944 5923078164 06286 20899 86280 34825 34211 70679 82148 08651 32823 06647 09384 46095 50582 23172 53594 08128 48111 74502 84102 70193 85211 05559 64462 29489 54930 38196 44288 10975 66593 34461 28475 64823 37867 83165 27120 19091 45648 56692 34603 48610 45432 66482 13393 60726 02491 41273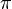 = 3.
= 3.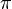 = 3.
= 3.